Ở bài trước chúng ta đã đi tìm hiểu xem Nguyên tử khối và đồng vị của Rubi, thì ở bài này chúng ta đi tìm hiểu xem Rubi ( Rb ) là gì? Cấu tạo và tính chất hóa học của Rubi ( Rb ). Rubidi là một kim loại màu trắng bạc, mềm và dẻo. Rubidi là nguyên tố có độ âm điện đứng hàng thứ hai trong số các kim loại kiềm ổn định (sau xêzi, do franci là nguyên tố phóng xạ) và nó bị hóa lỏng ở nhiệt độ 39,3 °C (102,7 °F).Giống như các nguyên tố nhóm 1 khác, kim loại này phản ứng dữ dội với nước để sinh ra hiđrô, tạo ra các hỗn hống với thủy ngân và tạo hợp kim với vàng, sắt, caesi, natri, và kali, nhưng không tạo hợp kim với lithi (mặc dù rubidi và lithi cùng một nhóm).
Rubi ( Rb ) là gì?
Rubidi (Rubidium) là một nguyên tố hóa học trong bảng tuần hoàn có ký hiệu Rb và số nguyên tử bằng 37. Rubidi kim loại rất mềm, có màu trắng bạc, có độ hoạt động hóa học cao như những nguyên tố kim loại kiềm khác. Rubidi phản ứng rất mạnh với nước, rất dễ bị oxi hóa trong không khí. Rubidi và các hợp chất của nó khi đốt sẽ cháy với ngọn lửa màu tím hồng.

Tính chất vật lí:
– Ion kim loại Rb không có màu. Hợp chất của chúng khá dễ tan trong nước.
– Có màu trắng bạc và ánh kim rất mạnh (ánh kim sẽ biến mất khi tiếp xúc vơi không khí).
– Nhiệt độ sôi: 689oC; nhiệt độ nóng chảy: 39oC; tỷ khối: 1,53 g/cm3.
– Kiểu mạng tinh thể: Lập phương tâm khối.
- Canxi ( Ca ) hóa trị mấy? Ca có nguyên tử khối là bao nhiêu?
- Mangan (Mn) có nguyên tử khối là bao nhiêu? Vai trò của Mn với cơ thể
- Nito có nguyên tử khối là bao nhiêu? Nito là kim loại hay phi kim
– Nhẹ, mềm có thể cắt bằng dao.
– Khi đốt cho ngọn lửa có màu tím hồng.
– Cần cất giữ Rb trong bình kín hoặc trong dầu hỏa khan.
– Tan được trong NH3 lỏng → những chất khử tốt.
Trạng thái tự nhiên:
– Rb có 1 số đồng vị; hỗn hợp của 2 đồng vị Rb85 (72,2%) và Rb87 (27,8%, có tính phóng xạ) và những đồng vị này đều có tính phóng xạ.
– Không tồn tại trong tự nhiên ở dạng kim loại tự do mà chỉ tồn tại ở dạng ion dương.
– Rb thuộc loại nguyên tố hiếm (chiếm 0,002% về khối lượng).
– Ngoài ra, Rb còn là nguyên tố phân tán.
Tính chất hóa học:
– Rb có thể hòa tan vào các kim loại kiềm khác; dễ tan trong thủy ngân để tạo thành hỗn hống.
Rất hoạt động hóa học → trong các phản ứng hóa học Rb thể hiện tính khử → Rb là chất khử mạnh.
– Tác dụng với H2:
![]()

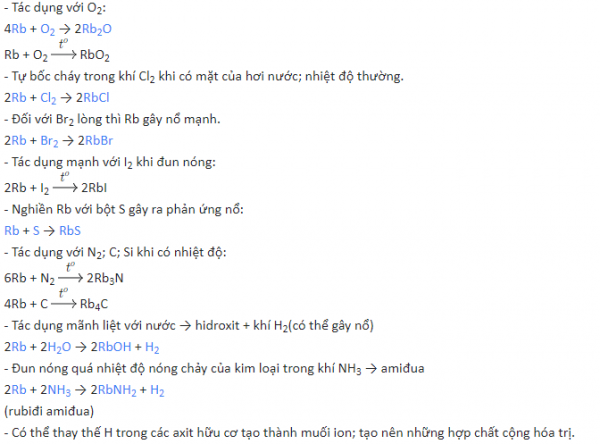
Điều chế:
Cách 1: Dùng canxi kim loại khử muối clorua của Rubidi ở nhiệt độ cao (700°C) và trong chân không.
2RbCl + Ca → CaCl2 + 2Rb
– Sau đó, Rubidi bay hơi và được làm ngưng tụ lại.
Cách 2: Ở nhiệt độ cao cũng có thể sử dụng quá trình sau:
3Mg + Rb2CO3 → 3MgO + C + 2Rb
Ứng dụng:
– Trong ngưng tụ Bose-Einstein.
– Chất lưu hoạt động trong các tua bin hơi; chất thu khí trong các ống chân không.
– Thành phần của tế bào quang điện; các đồng hồ nguyên tử.
– Thành phần trong một vài loại thủy tinh đặc biệt.
– Sản xuất superoxit bằng cách đốt cháy trong ôxy.
– Trong nghiên cứu các kênh ion kali trong sinh học.
– Hơi rubidi được sử dụng làm từ kế nguyên tử. Rb87 hiện tại được sử dụng, cùng các kim loại kiềm khác, trong phát triển một dạng từ kế là SERF (spin-exchange relaxation-free: trao đổi spin hồi phục tự do).
Xem thêm tại đây :
Nguyên tử khối là gì ? Bảng nguyên tử khối hóa học và mẹo học nhanh
Bảng Nguyên Tử Khối Các Nguyên Tố Hóa Học Lớp 8.
Nguyên tử khối của Rubi ( Rb )? Rubi có mấy đồng vị
Nguyên tử khối của đồng ( Cu )? Cấu hình Electron của nguyên tử Cu
Nguyên tử khối photpho ( P )? Photpho là kim loại hay phi kim
Nguyên tử khối của oxi ( O ), Oxi là phi kim có tính oxi hóa mạnh
